Lead Acid Battery
විද්යුත් ශක්තිය(Electrical Energy) , රසායනික ශක්තිය(Chemical Energy) බවය පරිවර්තනය කර ගබඩා කර අවශ්ය විටදී එම රසායනික ශක්තිය , විද්යුත් ශක්තිය බවට පරිවර්තනය කර ගත හැකි පරිදි නිපදවා ඇති බැටරි ද්වීතික බැටරි (Secondary battery) ලෙස හඳුන්වයි.
බාහිර විද්යුත් ප්රභවයක් යෙදීම මගින් විද්යුත් ශක්තිය රසායනික ශක්තිය බවට පරිවර්තනය කිරීම බැටරි ආරෝපණය (battery charging)ලෙසින් හැදින් වේ. ද්වීතික බැටරියේ සිට පිටතට ධාරා(Current) සැපයීමක් ලබා ගැනීම සදහා රසායනික ශක්තිය, විද්යුත් ශක්තිය බවට පරිවර්තනය කිරීම බැටරි විසර්ජනය (battery discharging)කිරීම ලෙස හැදින් වේ.
Lead - acid - battery යනු විද්යුත් ආරෝපණ ගබඩා කිරීම සදහා බහුලව භාවිතා වන බැටරි වර්ගයක් වේ. ද්වීතික බැටරි (Secondary battery) කාණ්ඩය යටතේ වර්ග කර ඇති මෙම බැටරි වල ඇති සුවිශේෂ වාසිය නම් නැවත නැවත ආරෝපණය කර භාවිතා කිරීමේ ඇති හැකියාවයි. මේ වාසිය නිසා lead-acid-battery මෝටර් රථ විදුලි පද්ධතිය සදහා අවශ්ය විදුලි අවශ්යතාව සපුරා ගැනීම සදහා අද වන විට බහුල වම භාවිතා කරනු ලබන බැටරි වර්ගය ලෙස සදහන් කල හැකිය.
ඊයම් අම්ල බැටරියක්(lead acid battery) තැනීම සදහා මූලික වශයෙන් මූලද්රව්ය තුනක් භාවිතා කරනු ලබයි:
1. Lead peroxide (PbO2).
2. Sponge lead (Pb)
3. Dilute sulfuric acid (H2SO4).
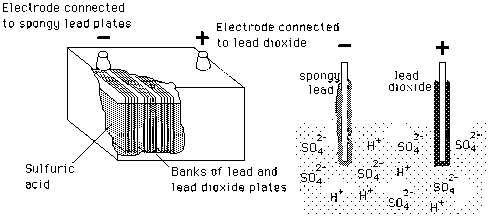
Lead acid battery සාදා ඇත්තේ Lead peroxide (PbO2) ඉලෙක්ට්රෝඩ සහ මෘදු ඊයම් [Sponge lead (Pb)] ඉලෙක්ට්රෝඩ , තනුක සල්පියුරික් අම්ලය [Dilute sulfuric acid (H2SO4)] තුල ගිල්වීම මගිනි. එලෙස සකසා ගන්නා ලද එක් බැටරි සෙල් එකක සාමාන්ය වෝල්ටීයතාවය 2v සිට 2.2v අතර අගයක පවතී. 6v බැටරියක් සදහා බැටරි සෙල් 3ක් ශේණිගත ව සම්බන්ධ (series-connected) කරමින් නිපදවා ඇති අතර, 12v බැටරියක් සදහා බැටරි සෙල් 6ක් ශේණිගත ව සම්බන්ධ කරමින් නිපදවා ඇත.
Lead acid battery සදහා භාවිතා කරනු ලබන තනුක සල්පියුරික් අම්ලය නිපදවා ගනු ලබන්නේ ජලයට [H2O(l)] , සාන්ද්ර සල්පියුරික් අම්ලය [H2SO4(l)] 3 : 1 අනුපාතයට මිශ කිරීම මගිනි. මෙම තනුක සල්පියුරික් අම්ලය තුල , අම්ලයේ අණු ධන H+(aq) අයන ලෙස සහ SO42-(aq) අයන ලෙස බෙදී ද්රාවණය තුල නිදහසේ පවතී.
H2SO4(l) + H2O(l) –> SO42-(aq) + H+(aq) + e
Working Principle of Lead Acid Battery
Lead-acid-battery සදහා භාවිතා කරනු ලබන විද්යුත් විච්ඡේදන ද්රාවණය සදහා තනුක සල්පියුරික් ආම්ලික ද්රාවණයක් භාවිතා කරනු ලබයි. මෙම විද්යුත් විච්ඡේදන ද්රාවණය තුල H+ ධන අයන ලෙසින් සහ SO4(-2) සෘන අයන ලෙසින් රසායනිකව වෙන් වී නිදහසේ පවතී. මෙහි සෘන ඉලෙක්ට්රෝඩය කැතෝඩය ලෙසින් හඳුන්වනු ලබන අතර එය Sponge lead (Pb) මගින් නිර්මාණය කර ගෙන ඇත. ධන ඉලෙක්ට්රෝඩය ඇනෝඩය ලෙසින් හඳුන්වනු ලබන අතර එය lead peroxide (Pbo2) මගින් නිර්මාණය කර ගෙන ඇත. මෙලෙස නිර්මාණය කර ගෙන ඇති ඇනෝඩය සහ කැතෝඩය විද්යුත් විච්ඡේදන ද්රාවණය තුල ගිල්වා බාහිර සරළ ධාරා සැපයුමකට සම්බන්ධ කල විට , ද්රාවනය තුල පවතින ධන ආරෝපිත H+ අයන භාහිර සැපයුමෙහි සෘන විභවයට සම්බන්ධිත ඉලෙක්ට්රෝඩය එනම් කැතෝඩය දෙසට ආකර්ෂණය වේ. මෙලෙසින්ම ද්රාවණය තුල පවතින සෘන ආරෝපිත SO4(-2) sulphate අයන බාහිර සැපයුමෙහි ධන විභවයට සම්බන්ධිත ඉලෙක්ට්රෝඩය එනම් ඇනෝඩය දෙසට ආකර්ෂණය වීම සිදු වේ.
ඇනෝඩය වෙත එහෙම නැත්තන් ධන ඉලෙක්ට්රෝඩය වෙත ආකර්ෂණය වූ සෑම SO4(-2) salfat සෘන අයනයක් ම , ඇනෝඩය මගින් සෘන අයන දෙක බැගින් ලබාගෙන ජලය සමග ප්රතික්රියා කරමින් සල්පියුරික් අම්ලය නිපදවීම සිදු කරනු ලබයි.
මෙලෙස බාහිර සරල ධාරා විදුලි සැපයුමට සම්බන්ධිත කැතෝඩය සහ ඇනෝඩය මගින් විද්යුත් විච්ඡේදන ද්රාවණය තුල සිදු වන රසායනික ප්රතික්රියා හේතුවෙන් ද්රාවණය තුල ආම්ලිකතාව ක්රමයෙන් ඉහළ යාම සිදු වේ.
ඉහත සිදු වන රසායනික ප්රතික්රියාවන් මගින් ද්රාවණයට නිදහස් වන ඔක්සිජන් අයන සහ ඇනෝඩයේ පවතින PbO සමග ප්රතික්රියා කරමින් PbO2 බවට පරිවර්තනය වීම සිදු වේ. මෙලෙස ධන ඉලෙක්ට්රෝඩය මත සිදු වන රසායනික ප්රතික්රියාව හේතුවෙන් මෙම ඉලෙක්ට්රෝඩය චොකලට් දුඹුරු වර්ණයක් ලබා ගනී.
මීට සමගාමීව කැතෝඩය මත පවතින PbSO4 නැවත Sponch Lead බවට පරිවර්තනය වීම සිදු වේ. මේ නිසා සෘන ඉලෙක්ට්රෝඩය සුදු පැහැයට හුරු අළු වර්ණයක් ලබා ගනී.
ඉලෙක්ට්රෝඩ වෙත සපයා ඇති බාහිර සරල ධාරා සැපයුම ඉවත් කර වෝල්ට් මීටරයක් සම්බන්ධ කල විට , එම ඉලෙක්ට්රෝඩ දෙක අතර විභව වෙනසක් පෙන්වනු ලබයි. මෙම ඉලෙක්ට්රෝඩ දෙක සුදුසු සම්බන්ධ තාවයක් මගින් බාහිර විද්යුත් විද්යුත් පරිපථයකට සම්බන්ධ කර ගත් විට , ධන ඉලෙක්ට්රෝඩයේ සිට සෘන ඉලෙක්ට්රෝඩය දක්වා විද්යුත් ධාරා ප්රවාහයක් හට ගනී. මේ නිසා මෙලෙස නිර්මාණය කර ගත් විද්යුත් කෝෂයක් මගින් , ඒ තුල ගබඩා කර ගත් විද්යුත් ශක්තිය නැවතත් බාහිරින් සම්බන්ධ කරනු ලබන විද්යුත් පරිපථ වෙත ලබා ගැනීමේ හැකියාව පවතින බව මෙමගින් පැහැදිලි වේ.
විසර්ජනය (Discharging)
බැටරිය විසර්ජනය වීමේ දී පහත පරිදි රසායනික ප්රතික්රියාවක් සිදු කරමින් බැටරිය ගැල්වනයිස් කෝශයක් (galvanic cell) ලෙස ක්රියා කරයි.
බැටරිය විසර්ජනය වන විට(බැටරියෙ සිට පිටතට ධාරාවක් ලබා ගන්නා නිසා) බැටරියේ සෘන ඉලෙක්ට්රෝඩය සාදා ඇති spongy lead වල ඇති පරමාණු , SO42-(aq) අණු සමග ඒකාබද්ධ වී සහ හයිඩ්රිජන් වායුව(H2(g)) නිපදවේ. සෑම විටම සෘන ඉලෙක්ට්රෝඩ මත ඉලෙක්ට්රෝන එකට එක් වී තැම්පත් වීම නිසා සෘන විභවයක් පවත්වා ගැනීමට හැකි වේ. විද්යුත් විච්ඡේදන ද්රාවණයේ ඇති H+(aq) පරමාණු ධන ඉලෙක්ට්රෝඩයේ ඇති PbO2(s) සමග සංයෝජනය වී ධන විභවයක් පවත්වා ගෙන යාම සදහා , ධන ඉලෙක්ට්රෝඩයෙන් ඉලෙක්ට්රෝන ඉවත් කිරීම රසායනික ව සිදු වනු ලබයි. මේ නිසා ධන ඉලෙක්ට්රෝඩයේ ඇති PbO2(s) සහ ද්රාවනයේ ඇති H+(aq) අයන සංයෝජනය වීමෙන් ජලය H2O(l) සහ , PbSO4(s) නිපදවීම සිදු වේ. මෙලෙස නිපදවෙන ජලය H2O(l) නිසා විද්යුත් විච්ඡේදන ද්රාවණය තවදුරටත් තනුක වෙමින් දුර්වල ද්රාවණයක් වීම සිදු වේ. ධන ඉලෙක්ට්රෝඩයේ සහ සෘන ඉලෙක්ට්රෝඩයේ නිපදවෙන PbSO4(s) ඉලෙක්ට්රෝඩ මත තැන්පත් වීම නිසා බැටරියේ තුල සිදු වන ප්රතික්රියාකාරී මට්ටම පහත බැසීම සිදු වේ. ඉහත සදහන් කල කරුනු නිසා බැටරිය තුල ඇති බැටරි සෙල් වල කාර්යක්ශමතාවය අඩු වී අවසානයේ බැටරියේ ප්රතිදාන වෝල්ටීයතාවය පහත වැටීම සිදු වේ.
Negative:
Pb(s) + HSO4– + H2O(l) –> 2e– + PbSO4(s) + H3O+(aq) (oxidation )
Positive:
PbO2(s) + HSO4–(aq) + 3H3O+(aq) + 2e– –> PbSO4(s) + 5H2O(l) (reduction)
ආරෝපණය(Recharging)
ඊයම් අම්ල බැටරියක් නැවත ආරෝපණය කිරීමේ දී පහත පරිදි ප්රතික්රියාවන් සිදු වේ.
බැටරිය නැවත ආරෝපණය කිරීම යනු බැටරිය තුල ඇති එක් එක් සෙල් එකෙහි ධන ඉලෙක්ට්රෝඩ වෙත විද්යුත් ධාරාවක්(electric current) ගලා යාමට සැලස් වීමයි. මෙම සපයනු ලබන ධාරාව මගින් සෘන ඉලෙක්ට්රෝඩයේ ඇති PbSO4(s) හා ද්රාවනයේ ඇති H+(aq) පරමාණු සමග එක් වීම හේතුවෙන් විද්යුත් විච්ඡේදන ද්රාවණයේ (H2SO4(aq)) සාන්ද්රණය ඉහල අතර සෘන ඉලෙක්ට්රෝඩ මත නැවත spongy lead සෑදීම සිදු වේ. මෙලෙස ධන ඉලෙක්ට්රෝඩ වල ඇති PbSO4(S) , ද්රාවනයේ ඇති H+(aq) සමග නැවත එකතු වී ධන තහඩුව මත PbO2(s) සහ විද්යුත් විච්ඡේදන ද්රාවණයේ සල්පියුරික් (H2SO4(aq)) අම්ලය ප්රතිජනනය වී සාන්ද්රණය ඉහල යයි. මෙලෙස බැටරිය තුල ඇති බැටරි සෙල් ආරෝපණය කිරීමේ අවසාන ප්රතිඵලය වන්නේ ඉලෙක්ට්රෝඩ නැවත සැකසෙන අතර විද්යුත් විච්ඡේදන ද්රාවණයේ (H2SO4(aq)) ආම්ලික සාන්ද්රනය ඉහල ගොස් බැටරියේ ක්රියාකාරී මට්ටම ඉහළ යාමයි.
Negative:
2e– + PbSO4(s) + H3O+(aq) –> Pb(s) + HSO4– + H2O(l) (reduction)
Positive:
PbSO4(s) + 5H2O(l) –> PbO2(s) + HSO4–(aq) + 3H3O+(aq) + 2e– (oxidation)
𝑺𝒑𝒆𝒄𝒊𝒇𝒊𝒄 𝑮𝒓𝒂𝒗𝒊𝒕𝒚 𝑶𝒇 𝑳𝒆𝒂𝒅-𝑨𝒄𝒊𝒅-𝑩𝒂𝒕𝒕𝒆𝒓𝒚
ඊයම් අම්ල බැටරිය පූර්ණ ලෙස ආරෝපිත (𝑭𝒖𝒍𝒍𝒚 𝑪𝒉𝒂𝒓𝒈𝒆) අවස්ථාවේ පවතින විට , එහි අන්තර්ගත ආම්ලික ද්රාවණය විශාල විද්යුත් බලයක් ජනනය කර ගත හැකි ලෙසින් නිර්මාණය වී පවතී. නමුත් ඊයම් අම්ල බැටරිය විසර්ජන (𝑫𝒊𝒔𝒉𝒄𝒉𝒂𝒓𝒈) අවස්ථාවට පත් වන විට , විද්යුත් කෝෂ ගිල්වා ඇති විද්යුත් ද්රාවකය දුර්වල තත්වයක් කරා ලං වීම සිදු වේ.
මෙසේ සිදු වන්නේ විද්යුත් ද්රාවකය තුල අන්තර්ගත අයන ඝනත්වයේ සිදු වන පහත වැටීම නිසාය. විද්යුත් ද්රාවකය තුල පවතින අයන ඝනත්වයේ හා ජල ද්රාවණ ඝනත්වයේ අනුපාතය 𝒔𝒑𝒆𝒄𝒊𝒇𝒊𝒄 𝒈𝒓𝒂𝒗𝒊𝒕𝒚 ලෙස හැදින් වේ. විද්යුත් විච්ඡේදන ද්රාවණයේ අන්තර්ගත 𝒔𝒑𝒆𝒄𝒊𝒇𝒊𝒄 𝒈𝒓𝒂𝒗𝒊𝒕𝒚 අගය භාවිතා කරමින් ඊයම් අම්ල බැටරියෙහි අන්තර්ගත ආරෝපණ ප්රමාණය පිළිබදව විස්තරයක් ලබා ගැනීමට හැකි වේ.
ඊයම් ආම්ල බැටරියෙහි (𝒍𝒆𝒂𝒅-𝒂𝒄𝒊𝒅-𝒃𝒂𝒕𝒕𝒆𝒓𝒚) අන්තර්ගත එක් එක් බැටරි කෝශ (𝑩𝒂𝒕𝒕𝒆𝒓𝒚 𝑪𝒆𝒍𝒍) තුල ඇති විද්යුත් ද්රාවකයේ විශිෂ්ට ගුරුත්ව මැන ගැනීම 𝒉𝒚𝒅𝒓𝒐𝒎𝒆𝒕𝒆𝒓 භාවිතයෙන් සිදු කර ගනී. විද්යුත් ද්රාවණය තුල අන්තර්ගත විශිෂ්ට ගුරුත්ව අගය 1100 සිට 1150 පරාසයක පවතින විට , විද්යුත් ද්රාවකයේ (𝑬𝒍𝒆𝒄𝒕𝒓𝒐𝒍𝒚𝒕𝒆) අන්තර්ගත ඝනත්වය ජලයේ ඝනත්වයට සාපේක්ෂව 1.1 සිට 1.5 ගුණනයකින් යුක්ත වේ. නමුත් විද්යුත් ද්රාවකයේ විශිෂ්ට ගුරුත්වය 1100~1150 අගය පරාසයක පවතින බැටරි කෝෂ පූර්ණ ලෙසින් විසර්ජන (𝑭𝒖𝒍𝒍𝒚 𝑫𝒊𝒔𝒄𝒉𝒂𝒓𝒈𝒆) අවස්ථාවේ පවතී. බැටරි කෝශයක් (𝑩𝒂𝒕𝒕𝒆𝒓𝒚 𝑪𝒆𝒍𝒍) තුල අන්තර්ගත විද්යුත් ද්රාවකයේ විශිෂ්ට ගුරුත්ව අගය 1280~1300 පරාසයක පතින විට , සලකනු ලබන බැටරි කෝෂය පූර්ණ ලෙසින් ආරෝපිත (𝑭𝒖𝒍𝒍𝒚 𝒄𝒉𝒂𝒓𝒈𝒆) අවස්ථාවේ පවතින බව උපකල්පනය කරයි.






Comments
Post a Comment